Галогени: фізичні властивості, хімічні властивості. Застосування галогенів та їхніх сполук
Галогени в періодичній таблиці розташованізліва від благородних газів. Ці п'ять токсичних неметалічних елементів входять в 7 групу періодичної таблиці. До них відносяться фтор, хлор, бром, йод і астат. Хоча астат радіоактивний і має тільки короткоживучі ізотопи, він веде себе, як йод, і його часто зараховують до галогенів. Оскільки галогенні елементи мають сім валентних електронів, їм необхідний лише один додатковий електрон для освіти повного октету. Ця характеристика робить їх більш активними, ніж інші групи неметалів.
Загальна характеристика
Галогени утворюють двохатомних молекул (виду Х2, Де Х позначає атом галогену) - стійкуформу існування галогенів у вигляді вільних елементів. Зв'язки цих двоатомних молекул є неполярними, ковалентними і одинарними. Хімічні властивості галогенів дозволяють їм легко вступати в з'єднання з більшістю елементів, тому вони ніколи не зустрічаються в незв'язаному вигляді у природі. Фтор - найбільш активний галоген, а астат - найменш.
Всі галогени утворюють солі I групи з подібними властивостями. У цих з'єднаннях галогени присутні у вигляді галоїдних аніонів з зарядом -1 (наприклад, Cl-, Br-). Закінчення -ід вказує на наявність галогенид-аніонів; наприклад Cl- називається «хлорид».
Крім того, хімічні властивості галогенівдозволяють їм діяти в якості окислювачів - окисляти метали. Більшість хімічних реакцій, в яких беруть участь галогени - окислювально-відновні у водному розчині. Галогени утворюють одинарні зв'язку з вуглецем або азотом в органічних сполуках, де ступінь їх окислення (СО) дорівнює -1. Коли атом галогену заміщений ковалентно-пов'язаних атомом водню в органічному поєднанні, префікс гало- може бути використаний в загальному сенсі, або префікси фтор, хлор, бром, йод - для конкретних галогенів. Галогенні елементи можуть мати перехресну зв'язок з освітою двоатомних молекул з полярними ковалентними одинарними зв'язками.
Хлор (Cl2) Став першим галогеном, відкритим в 1774 р, потім були відкриті йод (I2), Бром (Br2), Фтор (F2) І астат (At, виявлений останнім, в 1940 г.). Назва «галоген» походить від грецького коріння hal- ( «сіль») і -gen ( «утворювати»). Разом ці слова означають «солеобразующіе», підкреслюючи той факт, що галогени, вступаючи в реакцію з металами, утворюють солі. Галіт - це назва кам'яної солі, природного мінералу, що складається із суміші хлориду натрію (NaCl). І, нарешті, галогени використовуються в побуті - фторид міститься в зубній пасті, хлор знезаражує питну воду, а йод сприяє виробленню гормонів щитовидної залози.
Хімічні елементи
Фтор - елемент з атомним номером 9, позначаєтьсясимволом F. Елементарний фтор вперше був виявлений в 1886 р шляхом виділення його з плавикової кислоти. У вільному стані фтор існує у вигляді двоатомних молекули (F2) І є найбільш поширеним галогеномв земній корі. Фтор - найбільш електронегативний елемент в періодичній таблиці. При кімнатній температурі є блідо-жовтим газом. Фтор також має відносно невеликий атомний радіус. Його СО - -1, за винятком елементарного двухатомного стану, в якому його ступінь окислення дорівнює нулю. Фтор надзвичайно хімічно активний і безпосередньо взаємодіє з усіма елементами, крім гелію (He), неону (Ne) і аргону (Ar). У розчині H2O, плавикової кислоти (HF) є слабкоюкислотою. Хоча фтор сильно електроотріцателен, його електронний торгівельний не визначає кислотність; HF є слабкою кислотою в зв'язку з тим, що іон фтору основний (рН> 7). Крім того, фтор виробляє дуже потужні окислювачі. Наприклад, фтор може вступати в реакцію з інертним газом ксеноном і утворює сильний окислювач дифторид ксенону (XeF2). У фтору безліч застосувань.

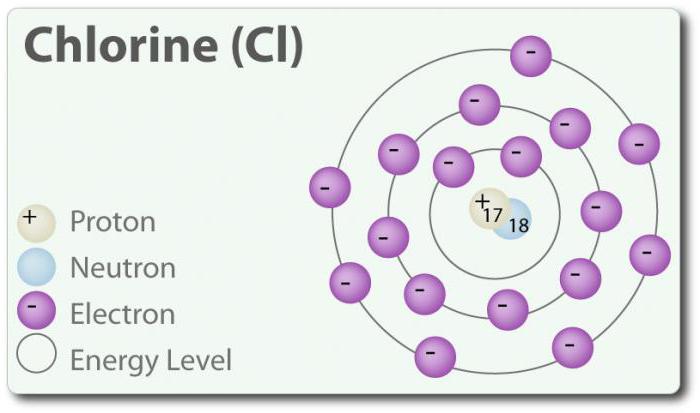
Хлор - елемент з атомним номером 17 і хімічним символом Cl. Виявлено в 1774 р шляхом виділення його з соляної кислоти. У своєму елементарному стані він утворює двоатомних молекул Cl2. Хлор має кілька СО: -1, +1, 3, 5 і 7. При кімнатній температурі він є світло-зеленим газом. Так як зв'язок, яка утворюється між двома атомами хлору, є слабкою, молекула Cl2 має дуже високу здатність вступати вз'єднання. Хлор реагує з металами з утворенням солей, які називаються хлориди. Іони хлору є найбільш поширеними іонами, вони містяться в морській воді. Хлор також має два ізотопи: 35Cl і 37Cl. Хлорид натрію є найбільш поширеним з'єднанням з усіх хлоридів.
Бром - хімічний елемент з атомним номером 35 і символом Br. Вперше був виявлений в 1826 р елементарної формі бром є двухатомной молекулою Br2. При кімнатній температурі являє собою червонувато-коричневу рідину. Його СО - -1, + 1, 3, 4 і 5. Бром активніший, ніж йод, але менш активний, ніж хлор. Крім того, бром має два ізотопи: 79Вг і 81Вг. Бром зустрічається у вигляді солей броміду, розчинених в морській воді. За останні роки виробництво броміду в світі значно збільшилася завдяки його доступності та тривалого часу життя. Як і інші галогени, бром є окислювачем і дуже токсичний.
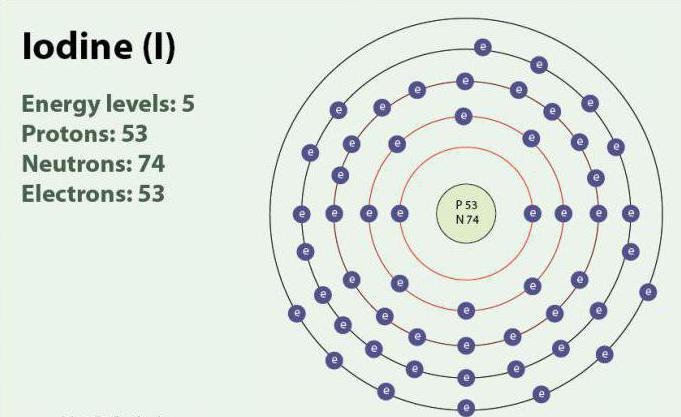
Йод - хімічний елемент з атомним номером 53 і символом I. Йод має ступеня окислення: -1, +1, +5 і +7. Існує у вигляді двоатомних молекули, I2. При кімнатній температурі є твердою речовиною фіолетового кольору. Йод має один стабільний ізотоп - 127I. Вперше виявлений в 1811 р за допомогою морських водоростей і сірчаної кислоти. В даний час іони йоду, можуть бути виділені в морській воді. Незважаючи на те що йод не дуже добре розчинний у воді, його розчинність може зрости при використанні окремих йодидов. Йод відіграє важливу роль в організмі, беручи участь у виробленні гормонів щитовидної залози.

Астат - радіоактивний елемент з атомним номером85 і символом At. Його можливі ступені окислення: -1, +1, 3, 5 і 7. Єдиний галоген, який не є двухатомной молекулою. У нормальних умовах є металевим твердим речовиною чорного кольору. Астат є дуже рідкісним елементом, тому про нього відомо небагато. Крім того, астат має дуже короткий період напіврозпаду, що не довше декількох годин. Отримано в 1940 р в результаті синтезу. Вважають, що астат схожий на йод. Відрізняється металевими властивостями.
У таблиці нижче показано будову атомів галогенів, структура зовнішнього шару електронів.
галоген | конфігурація електронів |
фтор | 1s2 2s2 2p5 |
хлор | 3s2 3p5 |
бром | 3d10 4s2 4p5 |
йод | 4d10 5s2 5p5 |
астат | 4f14 5d10 6s2 6p5 |
Подібним чином зовнішнього шару електронів обумовлює те, що фізичні і хімічні властивості галогенів схожі. Разом з тим при зіставленні цих елементів спостерігаються і відмінності.
Періодичні властивості в групі галогенів
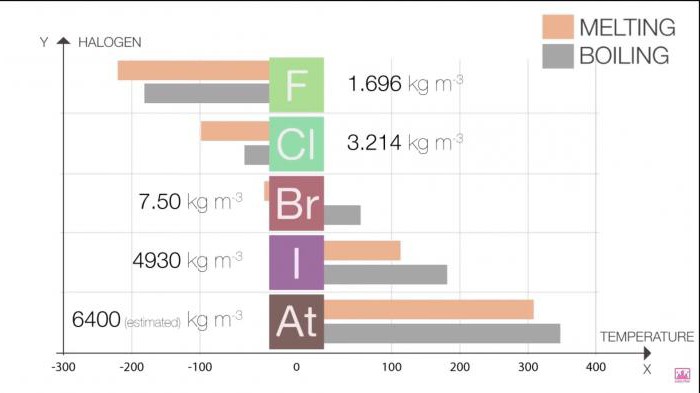
Фізичні властивості простих речовин галогенів змінюються з підвищенням порядкового номера елемента. Для кращого засвоєння і більшої наочності ми пропонуємо вам кілька таблиць.
Точки плавлення і кипіння в групі зростають у міру зростання розміру молекули (F <Cl <Br <I <At). Це збільшення означає збільшення сили Ван-дер-Ваальса.
Таблиця 1. Галогени. Фізичні властивості: точки плавлення і кипіння
галоген | Т плавлення (˚C) | Т кипіння (˚C) |
фтор | -220 | -188 |
хлор | -101 | -35 |
бром | -7.2 | 58.8 |
йод | 114 | 184 |
астат | 302 | 337 |
- Атомний радіус збільшується.
Розмір ядра збільшується (F <Cl <Br <I <At),так як збільшується число протонів і нейтронів. Крім того, з кожним періодом додається все більше рівнів енергії. Це призводить до більшої орбіталі, і, отже, до збільшення радіусу атома.
Таблиця 2. Галогени. Фізичні властивості: атомні радіуси
галоген | Ковалентний радіус (пм) | Іонний (X-) Радіус (пм) |
фтор | 71 | 133 |
хлор | 99 | 181 |
бром | 114 | 196 |
йод | 133 | 220 |
астат | 150 |
- Енергія іонізації зменшується.
Якщо зовнішні валентні електрони не перебуваютьпоблизу ядра, то для їх видалення від нього не буде потрібно багато енергії. Таким чином, енергія, необхідна для виштовхування зовнішнього електрона не настільки висока в нижній частині групи елементів, так як тут більше енергетичних рівнів. Крім того, висока енергія іонізації змушує елемент проявляти неметалічні якості. Йод і дисплей астат виявляють металеві властивості, тому що енергія іонізації знижується (At <I <Br <Cl <F).
Таблиця 3. Галогени. Фізичні властивості: енергія іонізації
галоген | Енергія іонізації (кДж / моль) |
фтор | 1681 |
хлор | 1251 |
бром | 1140 |
йод | 1008 |
астат | 890 ± 40 |
- Електронегативність зменшується.
Число валентних електронів в атомі зростає ззбільшенням рівнів енергії при прогресивно більш низьких рівнях. Електрони прогресивно далі від ядра; Таким чином, ядро і електрони не як притягуються один до одного. Збільшення екранування спостерігається. Тому Електронегативність зменшується з ростом періоду (At <I <Br <Cl <F).
Таблиця 4. Галогени. Фізичні властивості: електронний торгівельний
галоген | електронегативність |
фтор | 4.0 |
хлор | 3.0 |
бром | 2.8 |
йод | 2.5 |
астат | 2.2 |
- Спорідненість до електрону зменшується.
Так як розмір атома збільшується зі збільшеннямперіоду, спорідненість до електрону, як правило, зменшується (В <I <Br <F <Cl). Виняток - фтор, спорідненість якого менше, ніж у хлору. Це можна пояснити меншим розміром фтору в порівнянні з хлором.
Таблиця 5. Спорідненість галогенів до електрону
галоген | Спорідненість до електрону (кДж / моль) |
фтор | -328.0 |
хлор | -349.0 |
бром | -324.6 |
йод | -295.2 |
астат | -270.1 |
- Реактивність елементів зменшується.
Реакційна здатність галогенів падає з ростомперіоду (At <I <Br <Cl <F). Це пов'язано зі збільшенням радіуса атома зі зростанням рівнів енергії електронів. Це знижує тяжіння валентних електронів інших атомів, знижуючи реакційну здатність. Це зменшення також відбувається через падіння електронегативності зі збільшенням періоду, що також знижує тяжіння електронів. Крім того, зі збільшенням розміру атома знижується і окислювальна здатність.
Неорганічна хімія. Водень + галогени
Галогенід утворюється, коли галоген реагує з іншим, менш електронегативний елементом з утворенням бінарного з'єднання. Водень реагує з галогенами, утворюючи галогеніди виду НХ:
- фтороводород HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводорода HI.
Галогеніди водню легко розчиняються у воді з утворенням галогенводородной (плавиковою, соляною, бромистоводневої, іодістоводородной) кислоти. Властивості цих кислот наведені нижче.
Кислоти утворюються наступної реакцією: HX (aq) + H2O (l) → Х- (Aq) + H3O+ (Aq).
Все галоидоводородов утворюють сильні кислоти, за винятком HF.
Кислотність галогеноводородних кислот збільшується: HF <HCl <HBr <HI.
Плавикова кислота здатна гравірувати скло і деякі неорганічні фториди тривалий час.
Може здатися нелогічним, що HF єнайслабшою галогенводородной кислотою, так як фтор має найвищу електронегативні. Проте зв'язок Н-F дуже сильна, в результаті чого кислота дуже слабка. Сильна зв'язок визначається короткою довжиною зв'язку і великою енергією дисоціації. З усіх галогенідів водню HF має найкоротшу довжину зв'язку і найбільшу енергію дисоціації зв'язку.
галогенні оксокислоти
Галогенні оксокислоти є кислоти з атомами водню, кисню і галогену. Їх кислотність може бути визначена за допомогою аналізу структури. Галогенні оксокислоти наведені нижче:
- Хлорнуватиста кислота HOCl.
- Хлориста кислота HClO2.
- Хлоратна кислота HClO3.
- Хлорне кислота HClO4.
- Бромноватистой кислота HOBr.
- Бромноватой кислота HBrO3.
- Бромная кислота HBrO4.
- Иодноватистая кислота HOI.
- Йодноватої кислота HIO3.
- Метайодная кислота HIO4, H5IO6.
У кожній з цих кислот протон пов'язаний з атомомкисню, тому порівняння довжин зв'язків протонів тут марно. Домінуючу роль тут відіграє електронний торгівельний. Активність кислотні зростає зі збільшенням числа атомів кисню, пов'язаний з центральним атомом.
Зовнішній вигляд і стан речовини
Основні фізичні властивості галогенів коротко можна сформулювати в наступній таблиці.
Стан речовини (при кімнатній температурі) | галоген | Зовнішній вигляд |
тверде | йод | фіолетовий |
астат | чорний | |
рідке | бром | червоно-коричневий |
газоподібне | фтор | блідо-жовто-коричневий |
хлор | блідо-зелений |
Пояснення зовнішнього вигляду
Колір галогенів є результатом поглинаннявидимого світла молекулами, що викликає збудження електронів. Фтор поглинає фіолетове світло, і, отже, виглядає світло-жовтим. Йод, навпаки, поглинає жовте світло і виглядає фіолетовим (жовтий і фіолетовий - доповнюють кольору). Колір галогенів стає темніше з ростом періоду.
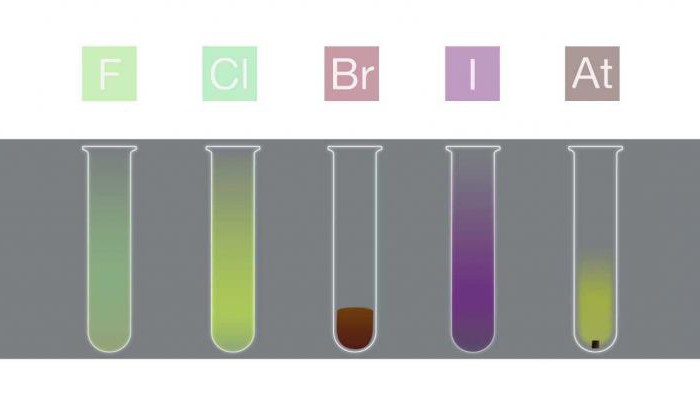
У закритих ємностях рідкий бром і твердий йод знаходяться в рівновазі зі своїми парами, які можна спостерігати у вигляді кольорового газу.
Хоча колір астату невідомий, передбачається, що він повинен бути темнішим йоду (т. Е. Чорним) відповідно до спостерігається закономірністю.
Тепер, якщо вас попросять: «Охарактеризуйте фізичні властивості галогенів», вам буде що сказати.
Ступінь окислення галогенів в з'єднаннях
Ступінь окислення часто використовується замістьпоняття "валентність галогенів". Як правило, ступінь окислення дорівнює -1. Але якщо галоген пов'язаний з киснем або іншим галогеном, він може приймати інші стани: СО кисню -2 має пріоритет. У разі двох різних атомів галогену, з'єднаних разом, більш електронегативний атом превалює і приймає СО -1.
Наприклад, в хлориде йоду (ICl) хлор має СО -1, і йод +1. Хлор є більш електронегативний, ніж йод, тому його СО дорівнює -1.
У бромной кислоті (HBrO4) Кисень має СО -8 (-2 х 4 атома = -8). Водень має загальну ступінь окислення +1. Додавання цих значень дає СО -7. Так як кінцеве СО з'єднання повинно бути нульовим, то СО брому дорівнює +7.
Третім винятком з правила є ступінь окислення галогену в елементарній формі (X2), Де його СО дорівнює нулю.
галоген | СО в з'єднаннях |
фтор | -1 |
хлор | -1, +1, +3, +5, +7 |
бром | -1, +1, +3, +4, +5 |
йод | -1, +1, +5, +7 |
астат | -1, +1, +3, +5, +7 |
Чому СО фтору завжди -1?
Електронегативність збільшується зі зростаннямперіоду. Тому фтор має найвищу електронний торгівельний з усіх елементів, що свідчить його місце в періодичній таблиці. Його електронна конфігурація 1s2 2s2 2p5. Якщо фтор отримує ще один електрон, крайнір-орбіталі повністю заповнені і складають повний октет. Оскільки фтор має високу електронегативність, він може легко відібрати електрон у сусіднього атома. Фтор в цьому випадку ізоелектронними інертного газу (з вісьмома валентними електронами), всі його зовнішні орбіталі заповнені. В такому стані фтор набагато стабільніший.
Отримання і застосування галогенів
У природі галогени знаходяться в стані аніонів,тому вільні галогени отримують методом окислення шляхом електролізу або за допомогою окислювачів. Наприклад, хлор виробляється гідролізом розчину кухонної солі. Застосування галогенів та їхніх сполук різноманітне.
- фтор. Незважаючи на те що фтор дуже реактивний, вінвикористовується в багатьох галузях промисловості. Наприклад, він є ключовим компонентів політетрафторетилену (тефлону) і деяких інших фторполимеров. Хлорфторвуглеці являють собою органічні хімічні речовини, які раніше використовувалися в якості холодоагентів і пропеллентов в аерозолях. Їх застосування припинилося через можливе їх впливу на навколишнє середовище. Їх замінили гідрохлорфторвуглеці. Фтор додають в зубну пасту (SnF2) І питну воду (NaF) для запобігання руйнуванню зубів. Цей галоген міститься в глині, використовуваної для виробництва деяких видів кераміки (LiF), використовується в ядерній енергетиці (UF6), Для отримання антибіотика фторхинолона, алюмінію (Na3AlF6), Для ізоляції високовольтного обладнання (SF6).
- хлор також знайшов різноманітне застосування. Він використовується для дезінфекції питної води і плавальних басейнів. Гіпохлорит натрію (NaClO) є основним компонентом відбілювачів. Соляна кислота широко використовується в промисловості і лабораторіях. Хлор присутня в полівінілхлориді (ПВХ) і інших полімерах, які використовуються для ізоляції проводки, труб та електроніки. Крім того, хлор виявився корисним і у фармацевтичній промисловості. Лікарські засоби, що містять хлор, використовуються для лікування інфекцій, алергії і діабету. Нейтральна форма гідрохлориду - компонент багатьох препаратів. Хлор використовується також для стерилізації лікарняного обладнання та дезінфекції. У сільському господарстві хлор є компонентом багатьох комерційних пестицидів: ДДТ (діхлородіфенілтріхлоретан) використовувався в якості сільськогосподарського інсектициду, але його використання було припинено.

- бром, Завдяки своїй негорючості, застосовується дляпридушення горіння. Він також міститься в бромистий метил, пестициди, які використовуються для зберігання врожаю і придушення бактерій. Однак надмірне використання бромистого метилу було припинено через його впливу на озоновий шар. Бром застосовують при виробництві бензину, фотоплівки, вогнегасників, ліків для лікування пневмонії і хвороби Альцгеймера.
- йод відіграє важливу роль в належному функціонуванніщитовидної залози. Якщо організм не отримує достатньої кількості йоду, відбувається збільшення щитовидної залози. Для профілактики зобу даний галоген додають в кухонну сіль. Йод також використовується як антисептичний засіб. Йод міститься в розчинах, які використовуються для очищення відкритих ран, а також в дезінфікуючих спреях. Крім того, йодид срібла має важливе значення в фотографії.
- астат - радіоактивний і рідкоземельні галоген, тому ще ніде не використовується. Проте вважають, що цей елемент може допомогти йоду в регуляції гормонів щитовидної залози.




