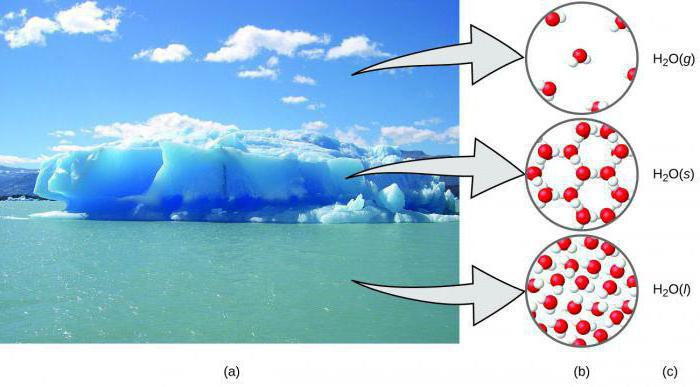
Макромолекула - це молекула з високою молекулярною масою. конфігурація макромолекули
Макромолекула - це молекула, яка маєвисоку молекулярну масу. Її структура представлена у вигляді багаторазово повторюваних ланок. Розглянемо особливості подібних з'єднань, їх значення для життєдіяльності живих істот.

особливості складу
Біологічні макромолекули утворюються з сотень тисяч невеликих вихідних речовин. Для живих організмів характерно три основних типи макромолекул: білки, полісахариди, нуклеїнові кислоти.
В якості вихідних мономерів для них виступаютьмоносахариди, нуклеотиди, амінокислоти. Макромолекула - це майже 90 відсотків маси клітин. Залежно від послідовності розташування амінокислотних залишків формується специфічна білкова молекула.
Високомолекулярними вважають ті речовини, які мають молярну масу більше 103 Так.

Історія появи терміна
Коли з'явилася макромолекула? Це поняття було введено нобелівським лауреатом в галузі хімії Германом Штаудінгером в 1922 році.
Полімерний клубок можна розглядати у виглядіпоплутаної нитки, яка утворилася при випадковому розмотування по всій кімнаті котушки. Цей клубок систематично змінює свою конформацію, це і є просторова конфігурація макромолекули. Вона подібна до траєкторією броунівського руху.
Відбувається утворення такого клубка через те,що на певній відстані полімерна ланцюжок «втрачає» інформацію про направлення. Говорити про клубку можна в тому випадку, коли високомолекулярні сполуки по довжині будуть набагато більше, ніж довжина структурного фрагмента.

глобулярна конфігурація
Макромолекула - це щільна конформація, вякої можна порівнювати об'ємну частку полімеру з одиницею. Глобулярна стан реалізується в тих випадках, коли при взаємній дії окремих ланок полімерів між собою і зовнішнім середовищем виникає взаємне притягання.
Реплікою структури макромолекули називають ту частину води, яка вбудована в якості елемента такої структури. Вона є найближчим гідратний оточенням макромолекули.

Характеристика білкової молекули
Макромолекули білків є гідрофільнимиречовинами. При розчиненні в воді сухого білка, спочатку воно набухає, потім спостерігається поступовий перехід в розчин. Під час набрякання відбувається проникнення молекул води всередину білка, зв'язування його структури полярними групами. При цьому розпушується щільна упаковка поліпептидного ланцюжка. Набряклу білкову молекулу вважають зворотним розчином. При подальшому поглинанні молекул води спостерігається відрив молекул білка від загальної маси, а також йде процес розчинення.
Але набухання білкової молекули не у всіх випадках викликає розчинення. Наприклад, колаген після поглинання молекул води залишається в набряклому стані.

гидратная теорія
Високомолекулярні сполуки по даній теорії непросто адсорбируют, відбувається електростатичне зв'язування молекул води з полярними фрагментами бічних радикалів амінокислот, які мають негативний заряд, а також основних амінокислот, які несуть позитивний заряд.
Частково гидратная вода зв'язується пептидними групами, що утворюють водневі зв'язки з молекулами води.
Наприклад, набухають поліпептиди, які маютьнеполярні бічні групи. При зв'язуванні з пептидними групами розсовує поліпептидні ланцюжки. Наявність межцепочних містків не дозволяє білкових молекул повністю відриватися, переходити в форму розчину.
Структура макромолекул руйнується при нагріванні, в результаті відбувається розрив і звільнення поліпептидних ланцюгів.
особливості желатину
За хімічним складом желатин аналогічний колагену, він утворює з водою в'язку рідину. Серед характерних властивостей желатину можна виділити його здатність до гелеутворення.
Такі види молекул застосовують як кровоспинних і плазмозамінних засобів. Здатність желатину утворювати гелі використовують при виробництві капсул у фармацевтичній промисловості.
Особливість розчинності макромолекул
Такі види молекул володіють різноюрозчинність в воді. Її визначають амінокислотним складом. При наявності в структурі полярних амінокислот здатність до розчинення у воді істотно збільшується.
Також на даний властивість впливає особливістьорганізації макромолекули. У глобулярних білків вище розчинність, ніж у фібрилярних макромолекул. В ході численних експериментів було встановлено залежність розчинення від характеристик використовуваного розчинника.
Первинна структура у кожної білкової молекули різна, що надає білку індивідуальність властивостей. Наявність поперечних зв'язків між поліпептидними ланцюгами знижує розчинність.
Первинна структура білкових молекул утворюється за рахунок пептидних (амідних) зв'язків, при її руйнуванні відбувається денатурація білка.
висолювання
Для збільшення розчинності білкових молекулвикористовують розчини нейтральних солей. Наприклад, подібним способом можна здійснити виборче осадження білків, провести їх фракціонування. Одержуване кількість молекул залежить від вихідного складу суміші.
Особливість білків, які виходять шляхом висолювання, полягає в збереженні біологічних характеристик після повного видалення солі.
Суть процесу полягає у видаленні аніонами ікатіонами солі гідратної білкової оболонки, що забезпечує стійкість макромолекули. Максимальна кількість молекул білка висолюють при використанні сульфатів. Даний спосіб використовують для очищення і розділення білкових макромолекул, так як вони істотно відрізняються за величиною заряду, параметрам гідратної оболонки. Кожен білок має свою зоною висолювання, тобто для нього потрібно підбирати сіль заданої концентрації.
амінокислоти
В даний час відомо близько двохсот амінокислот, які входять до складу білкових молекул. Залежно від будови, їх підрозділяють на дві групи:
- Протеїногенні, які входять до складу макромолекул;
- непротеіногенние, які не беруть активної участі в утворенні білків.
Вченим вдалося розшифрувати послідовністьамінокислот у багатьох білкових молекулах тваринного і рослинного походження. Серед амінокислот, які досить часто є в складі білкових молекул, відзначимо серин, гліцин, лейцин, аланін. Для кожного природного биополимера характерна наявність власного амінокислотного складу. Наприклад, протаміни включають близько 85 відсотків аргініну, але в них немає кислих, циклічних амінокислот. Фиброин - це білкова молекула натурального шовку, в якій міститься приблизно половина гліцину. У коллагене є такі рідкісні амінокислоти, як гидроксипролин, гідроксилізин, відсутні в інших білкових макромолекулах.
Амінокісотний склад визначається не лише особливостями амінокислот, але і функціями, призначенням білкових макромолекул. Їх послідовність обумовлюється генетичним кодом.
Рівні структурної організації біополімерів
Існує чотири рівні: первинний, вторинний, третинний, а також четвертинний. У кожної структури існують свої відмінні характеристики.
Первинна структура білкових молекул є лінійною полипептидную ланцюжок з амінокислотних залишків, пов'язаних пептидними зв'язками.
Саме ця структура є найстабільнішою, так як в ній існують пептидні ковалентні зв'язки між карбоксильною групою однієї амінокислоти і аміногрупою іншої молекули.
Вторинна структура передбачає укладання поліпептидного ланцюжка за допомогою водневих зв'язків в спіральну форму.
Третинний вид биополимера виходить при просторової укладанні поліпептиду. Поділяють спіральні і шарувато-складчасті форми теоретичних структур.
Для глобулярних білків характерна еліпсовою форма, а для фібрилярних молекул властива витягнута форма.
Якщо в макромолекулі міститься тільки однаполіпептидний ланцюг, білок має лише третинну структуру. Наприклад, це білок м'язової тканини (міоглобін), необхідний для зв'язування кисню. Деякі біополімери шикуються з декількох поліпептидних ланцюжків, у кожної з яких є третинна структура. В такому випадку макромолекула має четвертинної структурою, що складається з декількох глобул, об'єднаних у велику структуру. Гемоглобін можна вважати єдиним четвертинним білком, який містить близько 8 відсотків гистидина. Саме він є активним внутрішньоклітинним буфером в еритроцитах, що дозволяє підтримувати на стабільному рівні значення рН крові.
нуклеїнові кислоти
Вони є високомолекулярними сполуками,які утворюються фрагментами нуклеотидів. РНК і ДНК виявлені у всіх живих клітинах, саме вони виконують функцію зберігання, передачі, а також реалізації спадкової інформації. Як мономерів виступають нуклеотиди. Кожен з них має в складі залишок азотистого підстави, вуглеводу, а також фосфорної кислоти. Дослідження показали, що в ДНК різних живих організмів спостерігається принцип доповнення (комплементарності). Нуклеїнові кислоти розчинні у воді, але не розчиняються в органічних розчинниках. Ці біополімери руйнуються при підвищенні температури, ультрафіолетовому опроміненні.
замість висновку
Крім різних білків і нуклеїнових кислот,макромолекулами є вуглеводи. Полісахариди в своєму складі мають сотні мономерів, які мають приємний солодкуватий смак. Як приклади ієрархічної структури макромолекул можна привести величезні молекули білків і нуклеїнових кислот зі складними субодиницями.
Наприклад, просторова структура глобулярноїбілкової молекули є наслідком ієрархічної багаторівневої організації амінокислот. Між окремими рівнями існує тісний зв'язок, елементи більш високого рівня пов'язані з нижчими верствами.
Все біополімери виконують важливу подібну функцію. Саме вони є будівельним матеріалом для живих клітин, відповідають за зберігання і передачу спадкової інформації. Для кожної живої істоти характерні специфічні білки, тому перед биохимиками стоїть складне і відповідальне завдання, вирішуючи яку, вони рятують живі організми від вірної загибелі.
</ P>