Ступені окислення - це якась величина? Як визначити ступінь окислення елементів?
Такий предмет шкільної програми як хіміявикликає численні труднощі у більшості сучасних школярів, мало хто може визначити ступінь окислення в з'єднаннях. Найбільші складності у школярів, які вивчають неорганічну хімію, тобто учнів основної школи (8-9 класи). Нерозуміння предмета призводить до виникнення неприязні у школярів до вивчення предмета.
Педагоги виділяють цілий ряд причин такої«Нелюбові» учнів середніх і старших класів до хімії: небажання розбиратися в складних хімічних термінах, невміння користуватися алгоритмами для розгляду конкретного процесу, проблеми з математичними знаннями. Міністерством освіти РФ були внесені серйозні зміни в зміст предмета. До того ж "урізали" і кількість годин на викладання хімії. Це негативно позначилося на якості знань з предмета, зниження інтересу до вивчення дисципліни.

Які теми курсу хімії даються школярам найважче?
За новою програмою в курс навчальної дисципліни«Хімія» основної школи включено кілька серйозних тем: періодична таблиця елементів Д. І. Менделєєва, класи неорганічних речовин, іонний обмін. Найважче дається восьмикласникам визначення ступеня окислення оксидів.
Правила розстановки
Перш за все учні повинні знати, що оксидиє складними двоелементною сполуками, до складу яких включено кисень. Обов'язковою умовою приналежності бінарного з'єднання до класу оксидів є розташування кисню другим в даному з'єднанні.
Розрахувати такий показник в будь-яких формулах даного класу вийде, тільки якщо школяр володіє певним алгоритмом.
Алгоритм для кислотних оксидів
Для початку зауважимо, що ступеня окислення цечисельні вираження валентності елементів. Кислотні оксиди утворені неметаллами або металами з валентністю від чотирьох до семи, другим в таких оксидах обов'язково варто кисень.
В оксидах валентність кисню завждивідповідає двом, визначити її можна по періодичній таблиці елементів Д. І. Менделєєва. Такий типовий неметалл як кисень, перебуваючи в 6 групі головної підгрупи таблиці Менделєєва, приймає два електрона, щоб повністю завершити свій зовнішній енергетичний рівень. Неметали в з'єднаннях з киснем найчастіше виявляють вищу валентність, яка відповідає номеру самої групи. Важливо нагадати, що ступінь окислення хімічних елементів це показник, який передбачає позитивне (від'ємне) число.
Неметалл, що стоїть на початку формули, володієпозитивної ступенем окислення. Неметалл кисень же в оксидах стабільний, його показник -2. Для того щоб перевірити достовірність розстановки значень в кислотних оксидах, доведеться перемножити всі поставлені вами цифри на індекси у конкретного елемента. Розрахунки вважаються достовірними, якщо сумарний підсумок всіх плюсів і мінусів поставлених ступенів виходить 0.

Складання двоелементний формул
Ступінь окислювання атомів елементів дає шансстворювати і записувати з'єднання з двох елементів. При створенні формули, для початку обидва символи прописують поруч, обов'язково другим ставлять кисень. Зверху над кожним із записаних знаків прописують значення ступенів окиснення, потім між знайденими числами знаходиться то число, що буде без будь-якого залишку ділитися на обидві цифри. Даний показник необхідно поділити окремо на числове значення ступеня окислення, отримуючи індекси для першого і другого компонентів двоелементною речовини. Вища ступінь окислення дорівнює чисельно значенням вищої валентності типового неметалла, ідентична номеру групи, де стоїть неметалл в ПС.
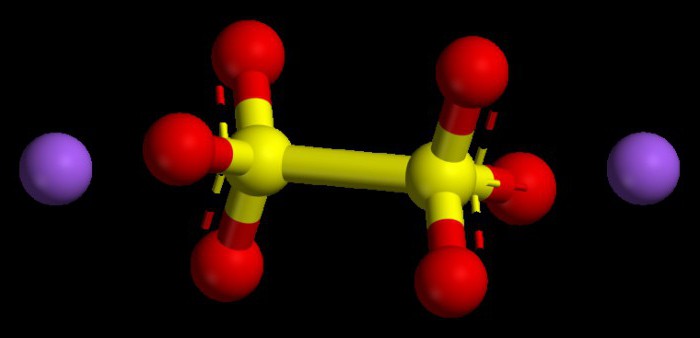
Алгоритм постановки числових значень в основних оксидах
Подібними сполуками вважаються оксиди типовихметалів. Вони у всіх з'єднаннях мають показник ступеня окислення не більше +1 або +2. Для того щоб зрозуміти, яку буде мати ступінь окислення метал, можна скористатися періодичної системою. У металів головних підгруп першої групи, даний параметр завжди постійний, він аналогічний номеру групи, тобто +1.
Метали основний підгрупи другої групи такожхарактеризуються стабільною ступенем окислення, в цифровому вираженні +2. Ступені окислення оксидів в сумі з урахуванням їх індексів (числа) повинні давати нуль, оскільки хімічна молекула вважається нейтральною, позбавленої заряду, часткою.
Розстановка ступенів окислення в кисневмісних кислотах
Кислоти являють собою складні речовини,що складаються з одного або декількох атомів водню, які пов'язані з якимось кислотним залишком. З огляду на, що ступеня окислення це цифрові показники, для їх обчислення будуть потрібні деякі математичні навички. Такий показник для водню (протона) в кислотах завжди стабільний, становить +1. Далі можна вказати ступінь окислення для негативного іона кисню, вона також стабільна, -2.
Лише тільки після цих дій, можна обчислюватиступінь окислення у центрального компонента формули. Як конкретний зразка розглянемо визначення ступеня окислення елементів в сірчаної кислоти H2SO4. З огляду на, що в молекулі даного складного речовини міститься два протона водню, 4 атома кисню, отримуємо вираз такого виду + 2 + X-8 = 0. Для того щоб в сумі утворювався нуль, у сірки буде ступінь окислення +6
Розстановка ступенів окислення в солях
Солі представляють собою складні з'єднання,що складаються з іонів металу і одного або декількох кислотних залишків. Методика визначення ступенів окислення у кожного з складових частин в складній солі така ж, як і в кисневмісних кислотах. З огляду на, що ступінь окислення елементів - це цифровий показник, важливо правильно визначити ступінь окислення металу.
Якщо метал, який утворює сіль, розташовується вголовній підгрупі, його ступінь окислення буде стабільною, відповідає номеру групи, є позитивною величиною. Якщо ж в солі міститься метал подібної підгрупи ПС, що виявляє різні валентності, визначити валентність металу можна по кислотному залишку. Після того як встановлено буде ступінь окислення металу, ставлять ступінь окислення кисню (-2), далі обчислюють ступінь окислення центрального елемента, скориставшись хімічним рівнянням.
Як приклад розглянемо визначенняступенів окислення у елементів в нітрат натрію (середньої солі). NaNO3. Сіль утворена металом головною підгрупи 1 групи, отже, ступінь окислення натрію буде +1. У кисню в нітрати ступінь окислення становить -2. Для визначення чисельного значення ступеня окислення становить рівняння + 1 + X-6 = 0. Вирішуючи дане рівняння, отримуємо, що X має бути +5, це і є ступінь окислення азоту.

Основні терміни в ОВР
Для окисного, а також відновного процесу існують спеціальні терміни, які зобов'язані вивчити школярі.
Ступінь окислювання атома це його безпосередня здатність приєднувати до себе (віддавати іншим) електрони від якихось іонів або ж атомів.
Окислювачем вважають нейтральні атоми або заряджені іони, в ході хімічної реакції приєднують себе електрони.
Відновлювачем стануть незаряджені атоми або заряджені іони, що в процесі хімічної взаємодії втрачають власні електрони.
Окислення представляється як процедура віддачі електронів.
Відновлення пов'язано з прийняттям додаткових електронів незарядженим атомом або іоном.
Окислювально-відновні процесихарактеризується реакція, в ході якої обов'язково змінюється ступінь окислення атома. Це визначення дозволяє зрозуміти, як можна визначити, чи є реакція ОВР.

Правила розбору ОВР
Користуючись даними алгоритмом, можна розставити коефіцієнти в будь-який хімічної реакції.
Для початку потрібно розставити в кожному хімічномуречовині ступеня окислення. Врахуйте, що в простому речовині ступінь окислення дорівнює нулю, так як відсутній віддача (приєднання) негативних частинок. Правила розстановки ступенів окислення в бінарних та трьохелементної речовин були нами розглянуті вище.
Потім потрібно визначити ті атоми або іони, у яких в ході події перетворення, змінилися ступеня окислення.
З лівої частини записаного рівняння виділяютьатоми або заряджені іони, які поміняли свої ступеня окислення. Це необхідно для складання балансу. Над елементами обов'язково вказують їх значення.
Далі записуються ті атоми або іони, якіутворилися в ході реакції, вказується знаком + кількість прийнятих атомом електронів, - число відданих негативних частинок. Якщо після процесу взаємодії зменшуються ступеня окислення. Це означає, що електрони були прийняті атомом (іоном). При підвищенні ступеня окислення атом (іон) в ході реакції віддають електрони.
Найменше спільне число ділять спочатку на прийняті, потім на віддані в процесі електрони, отримують коефіцієнти. Знайдені цифри і будуть шуканими стереохімічні коефіцієнтами.
Визначають окислювач, відновник, процеси, що протікають в ході реакції.
Останнім етапом буде розстановка стереохімічних коефіцієнтів в розглянутій реакції.
приклад ОВР
Розглянемо практичне застосування даного алгоритму на конкретній хімічної реакції.
Fe + CuSO4 = Cu + FeSO4
Розраховуємо показники у всіх простих і складних речовин.
Так як Fe і Cu є простими речовинами, їх ступінь окислення дорівнює 0. У CuSO4, то Cu + 2, тоді у кисню-2, а у сірки +6. У FeSO4: Fe +2, отже, для О-2, за розрахунками S +6.
Тепер шукаємо елементи, що змогли поміняти показники, в нашій ситуації ними виявляться Fe і Cu.
Так як після реакції значення у атома залізастала +2, в реакції було віддано 2 електрона. Мідь поміняла свої показники з +2 до 0, отже, мідь прийняла 2 електрона. Тепер визначаємо кількість прийнятих і відданих електронів атомом заліза і катіоном двухвалентной міді. В ході перетворення взято два електрона катіоном двухвалентной міді, стільки ж електронів віддано атомом заліза.
В даному процесі немає сенсу визначатимінімальне спільне кратне, оскільки прийнято і віддано в ході перетворення рівну кількість електронів. Стереохимические коефіцієнти будуть також відповідати одиниці. В реакції властивості відновника буде проявляти залізо, при цьому воно окислюється. Катіон двухвалентной міді відновлюється до чистої міді, в реакції у неї найвищий рівень окислення.

застосування процесів
Формули ступеня окислення повинні бути відомікожному школяреві 8-9 класу, так як дане питання включено до завдання ОГЕ. Будь-які процеси, які протікають з окисними, відновними ознаками, відіграють важливе значення в нашому житті. Без них неможливі обмінні процеси в організмі людини.
</ P>