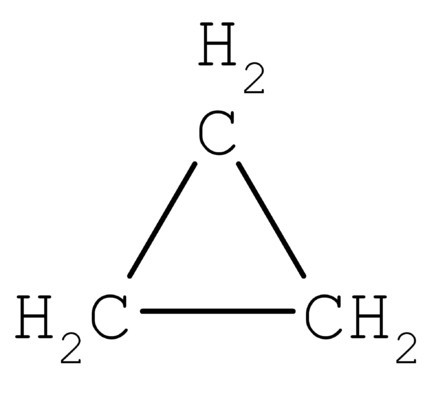
Поговоримо про те, як визначити тип гібридизації
Поговоримо про те, як визначити тип гібридизації, а також розглянемо геометричну будову молекули.
Історія появи терміна
На початку двадцятого століття Л. Полінглом була запропонована теорія геометрії молекул з ковалентним зв'язком. В якості основи для утворення зв'язку було взято перекривання електронних хмар. Метод стали називати валентними зв'язками. Як визначати тип гібридизації атомів в сполуках? Автор теорії пропонував враховувати змішування гібридних орбіталей.
визначення
Для того щоб зрозуміти, як визначити тип гібридизації в з'єднаннях, розберемо, що позначає цей термін.
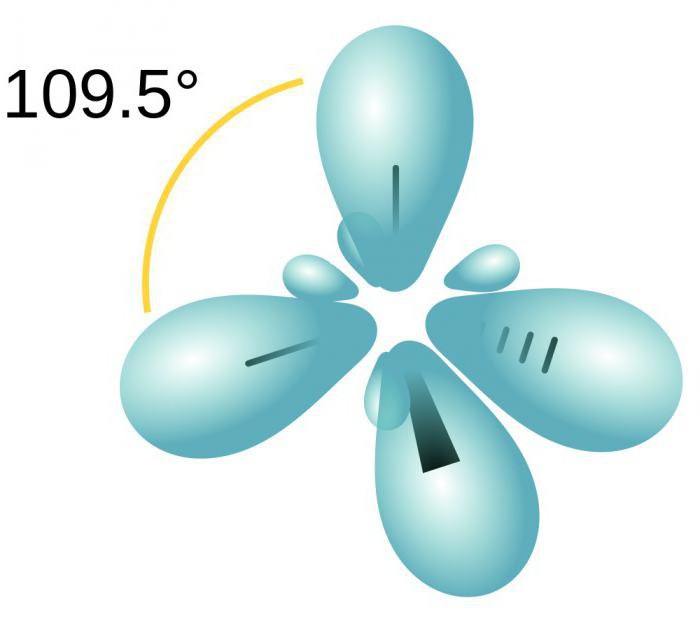
Гібридизація є змішуванняелектронних орбіталей. Даний процес супроводжується розподілом в них енергії, зміною їх форми. Залежно від того, в якій кількості будуть змішуватися s- і p-орбіталі, тип гібридизації може бути різним. В органічних сполуках атом вуглецю може існувати в стані sp, sp2, sp3. Є й більш складні форми, в яких беруть участь, крім sp, d-орбіталі.
Правила виявлення в молекулах неорганічних речовин
Виявити варіант гібридизації можна для з'єднаньз ковалентним хімічним зв'язком, мають тип АВП. А - основний атом, В - ліганд, п - число від двох і вище. У подібній ситуації в гібридизацію вступатимуть тільки валентні орбіталі головного атома.
способи визначення
Поговоримо докладніше про те, як визначити типгібридизації. У хімічному розумінні цей термін передбачає зміну енергії і форми орбіталей. Спостерігається подібний процес в тих випадках, коли для утворення зв'язку використовують електрони, які належать різним типам.

Щоб зрозуміти, як визначити тип гібридизації,розглянемо молекулу метану. Дана речовина є першим представником гомологічного ряду насичених (граничних) вуглеводнів. У просторі молекула СН4 є тетраедром. Єдиний атом вуглецю утворює з воднем зв'язку, подібні по енергії і довжині. Для того щоб утворилися такі гібридні хмари, використовуються три р- і один ес-електрон.
Чотири хмари змішуються, і виникає чотириоднакових (гібридних) виду, що мають форму неправильної вісімки. Називають такий тип гібридизації sp3. Всі вуглеводні, в складі яких тільки прості (одинарні) зв'язку, характеризуються саме таким типом гібридизації атома вуглецю. Валентний кут складає 109 градусів 28 хвилин.
Продовжуємо розмову про те, як визначити типгібридизації. Приклади ненасичених вуглеводнів ряду етилену дають уявлення про sp2-гібридизації. Наприклад, в молекулі етилену з чотирьох валентних електронів в утворенні хімічного зв'язку використовується тільки три. Що залишився негібридних р-електрон йде на освіту подвійного зв'язку.

Ацетилен є найпростішим представникомкласу СпН2п-2. Особливістю цього класу вуглеводнів є наявність потрійний зв'язку. З чотирьох валентних електронів вуглецевого атома тільки два змінюють свою форму і енергію, стаючи гібридними. Два залишилися електрона беруть участь в утворенні двох подвійних зв'язків, визначаючи ненасичений характер цього класу органічних сполук.
висновок
Розглядаючи питання, що стосується ковалентногохімічного зв'язку для органічних і для неорганічних речовин, враховують гібридизацію атомних орбіталей. При цьому відбувається вирівнювання їх енергії і форми. Електрон, що розташовується поблизу ядра пов'язаного атома, характеризується сукупністю орбіталей, які мають однаковий квантовим числом. Для отримання відомостей про гібридизації дає можливість оцінювати хімічні властивості речовини.
</ P>