Структурна і молекулярна формула: ацетилен
Особливості будови ацетилену впливають на його властивості, отримання та застосування. Умовне позначення складу речовини - С2Н2 - це його найпростіша і брутто-формула. Ацетилен утворений двома атомами вуглецю, між якими виникає потрійний зв'язок. Її наявність відображають різні види формул і моделей молекули Етін, що дозволяють розібратися в проблемі впливу будови на властивості речовини.
Алкіни. Загальна формула. ацетилен
Вуглеводні Алкіни, або ацетиленові, єациклическими, неграничними. Ланцюжок атомів вуглецю - не замкнута, в ній присутні прості і кратні зв'язку. Склад алкинов відображає зведена формула CnH2n - 2. У молекулах речовин цього класу присутнійодна або кілька потрійних зв'язків. Ацетиленові сполуки відносяться до ненасичених. Це означає, що тільки одна валентність вуглецю реалізується за рахунок водню. Решта три зв'язку використовуються при взаємодії з іншими атомами вуглецю.
Перший - і найбільш відомий представникалкинов - ацетилен, або Етін. Тривіальне назва речовини походить від латинського слова «acetum» - «оцет» і грецького - «hyle» - «дерево». Родоначальник гомологічного ряду був відкритий в 1836 році в хімічних дослідах, пізніше речовина синтезували з вугілля і водню Е. Деві і М. Бертло (1862 рік). При звичайній температурі і нормальному атмосферному тиску ацетилен знаходиться в газоподібному стані. Це безбарвний газ, без запаху, малорозчинний воді. Етін легше розчиняється в етанолі і ацетоні.

Молекулярна формула ацетилену
Етін - найпростіший член свого гомологічного ряду, його склад і будова відображають формули:
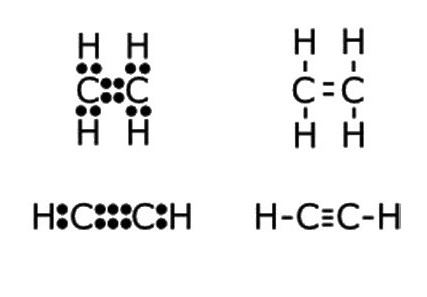
- З2Н2 - молекулярна запис складу Етін, яка даєуявлення про те, що речовина утворена двома вуглецевими атомами і таким же числом атомів водню. За цією формулою можна розрахувати молекулярну і молярну маси сполуки. Mr (С2Н2) = 26 а. е. м., М (С2Н2) = 26,04 г / моль.
- Н: С ::: З: Н - електронно-точкова формула ацетилену. Подібні зображення, що отримали назву «структури Льюїса», відображають електронну будову молекули. При написанні необхідно дотримуватися правила: атом водню прагне при утворенні хімічного зв'язку володіти конфігурацією валентної оболонки гелію, інші елементи - октетом зовнішніх електронів. Кожне двокрапка означає загальну для двох атомів або неподеленную пару електронів зовнішнього енергетичного рівня.
- H-C≡C-H - структурна формула ацетилену, що відображає порядок і кратність зв'язків між атомами. Одна рисочка замінює собою одну пару електронів.
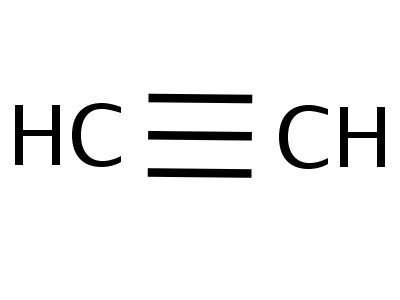
Моделі молекули ацетилену
Формули, що показують розподіл електронів,послужили фундаментом для створення атомно-орбітальних моделей, просторових формул молекул (стереохімічних). Ще в кінці XVIII століття набули поширення шаростержневие моделі - наприклад, кульки різного кольору і розміру, що позначають вуглець і водень, які утворюють ацетилен. Структурна формула молекули представлена у вигляді стрижнів, що символізують хімічні зв'язки і їх кількість у кожного атома.
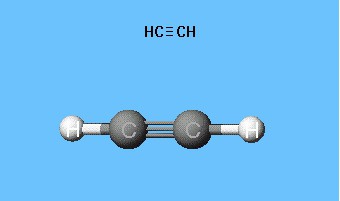
Шаростержневих модель ацетилену відтворюєвалентні кути, рівні 180 °, але меж'ядерние відстані в молекулі відображаються приблизно. Порожнечі між кульками не створюють уявлення про заповнення простору атомів електронної щільністю. Недолік усунуто в моделях Дрейдінга, що позначають ядра атомів немає кульками, а точками приєднання стрижнів один до одного. Сучасні об'ємні моделі дають більш яскраве уявлення про атомних і молекулярних орбіталях.
Гібридні атомні орбіталі ацетилену
Вуглець в збудженому стані містить три р-орбіталі і одну s з неспареними електронами. При утворенні метану (СН4) вони беруть участь в створенні рівноціннихзв'язків з атомами водню. Відомий американський дослідник Л. Полінг розробив вчення про гібридному стані атомних орбіталей (АО). Пояснення поведінки вуглецю в хімічних реакціях полягає у вирівнюванні АТ за формою і енергії, утворенні нових хмар. Гібридні орбіталі дають більш міцні зв'язки, стає стійкіше формула.
Атоми вуглецю в молекулі ацетилену, на відміну відметану, піддаються sp-гібридизації. За формою і енергії змішуються s- і р електрони. З'являються дві sp-орбіталі, що лежать під кутом 180 °, спрямовані по різні боки від ядра.
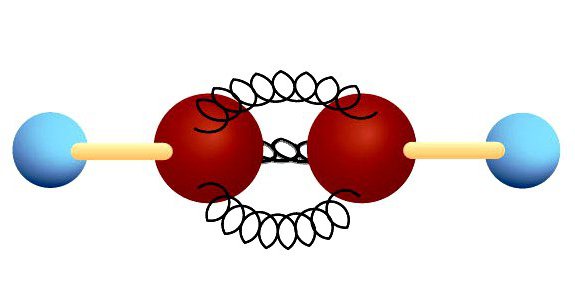
Потрійна зв'язок
У ацетилені гібридні електронні хмари вуглецюберуть участь у створенні σ-зв'язків з такими ж сусідніми атомами і з воднем в парах С-Н. Залишаються дві перпендикулярні один одному негібридних p-орбіталі. У молекулі Етін вони беруть участь в утворенні двох π-зв'язків. Разом з σ виникає потрійний зв'язок, яку відображає структурна формула. Ацетилен відрізняється від етану і етилену відстанню між атомами. Потрійна зв'язок коротше подвійний, але має великий запас енергії, є більш міцною. Максимальна щільність σ- і π-зв'язків розташована в перпендикулярних областях, що призводить до утворення циліндричного електронної хмари.
Особливості хімічного зв'язку в ацетилені
Молекула Етін має лінійну форму, що вдаловідображає хімічна формула ацетилену - H-C≡C-H. Атоми вуглецю і водню знаходяться вздовж однієї прямої, між ними виникають 3 σ- і 2 π-зв'язку. Вільний рух, обертання уздовж осі C-C неможливо, цьому перешкоджає наявність кратних зв'язків. Інші особливості потрійний зв'язку:
- кількість пар електронів, що зв'язують два атома вуглецю, - 3;
- довжина - 0,120 нм;
- енергія розриву - 836 кДж / моль.
Для порівняння: в молекулах етану і етилену довжина одинарної і подвійний хімічного зв'язку - 1,54 і 1,34 нм відповідно, енергія розриву С-С становить 348 кДж / моль, C = C - 614 кДж / моль.
гомологи ацетилену
Ацетилен - найпростіший представник алкинов, в молекулах яких також присутній потрійний зв'язок. пропін СН3С≡СН - гомолог ацетилену. Формула третього представника алкинов - Бутіна-1 - СН3СН2С≡СН. Ацетилен - тривіальне назва Етін. Систематична номенклатура алкинов підпорядковується правилам ІЮПАК:
- в лінійних молекулах вказується назва основному ланцюзі, що виник від грецького числівника, до якого додається суфікс-ін та номер атома при потрійний зв'язку, наприклад, Етін, пропін, бутин-1;
- нумерацію головною ланцюжка атомів починають з кінця молекули, найближчого до потрійного зв'язку;
- для розгалужених вуглеводнів спочатку йде найменування бічного відгалуження, потім слідує назва головної ланцюжка атомів з суфіксом -ін.
- заключна частина найменування - цифра, яка вказує розташування в молекулі потрійний зв'язку, наприклад, бутин-2.
Ізомерія алкінів. Залежність властивостей від будови
Етін і пропін не мають ізомерів положення потрійнийзв'язку, вони з'являються, починаючи з Бутіна. Ізомери вуглецевого скелета є у пентіна і наступних за ним гомологів. Щодо потрійний зв'язку не проявляється просторова ізомерія ацетиленових вуглеводнів.
Перші 4 гомолога Етін - гази, погано розчинні у воді. Ацетиленові вуглеводні C5 - C15 - рідини. Твердими речовинами є гомологи Етін, починаючи з вуглеводню C17. Хімічна природа алкинов відчуваєзначний вплив потрійний зв'язку. Вуглеводні цього типу активніше, ніж Етиленові, приєднують різні частки. На цій властивості засновано широке застосування Етін в промисловості і техніці. При горінні ацетилену виділяється велика кількість теплоти, що знаходить застосування в газовому різанні і зварюванні металів.
</ P>