Кремній та його сполуки. Кремній в природі. застосування кремнію
Одним з найбільш затребуваних в техніці іпромисловості елементів є кремній. Цьому він зобов'язаний своїми незвичайними властивостями. Сьогодні існує маса різних з'єднань даного елемента, які відіграють важливу роль в синтезі і створенні технічних продуктів, посуду, скла, обладнання, будівельних і оздоблювальних матеріалів, ювелірних прикрас і в інших галузях промисловості.

Загальна характеристика кремнію
Якщо розглядати стан кремнію в періодичній системі, то можна сказати так:
- Розташовується в IV групі головної підгрупи.
- Порядковий номер 14.
- Атомна маса 28,086.
- Хімічний символ Si.
- Назва - кремній, або на латині - silicium.
- Електронна конфігурація зовнішнього шару 4е: 2е: 8е.
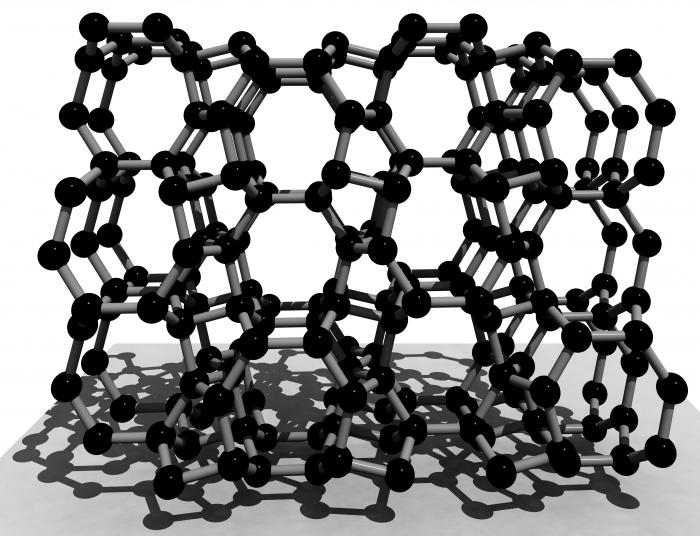
Кристалічна решітка кремнію подібна решітціалмазу. У вузлах розташовані атоми, тип її - кубічна гранецентрированная. Однак внаслідок більшої довжини зв'язку фізичні властивості кремнію сильно відрізняються від властивостей аллотропной модифікації вуглецю.
Фізичні та хімічні властивості
Існує дві аллотропние модифікації даногоелемента: аморфна і кристалічна. Вони дуже схожі. Однак, як і у випадку з іншими речовинами, головна відмінність між ними - кристалічна решітка кремнію.
При цьому обидві модифікації - це порошки різного кольору.
1. Кристалічний кремній є темно-сірий блискучий порошок, схожий на метал. Структура його відповідає алмазу, проте властивості відмінні. Він володіє:
- крихкістю;
- невисокою твердістю;
- напівпровідниковими властивостями;
- температурою плавлення 14150С;
- щільністю 2,33 г / см3;
- температурою кипіння 27000С.
Його хімічна активність невисока в порівнянні з іншого аллотропной формою.
2. Аморфний кремній - буро-коричневий порошок, володіє структурою сільноразупорядоченного алмазу. Хімічна активність досить висока.
В цілому слід зауважити, що вступати в реакції кремній не любить. Щоб змусити його реагувати, потрібна температура не менше 400-5000С. При цих умовах утворюються різні хімічні сполуки кремнію. Такі як:
- оксиди;
- галогеніди;
- силіциди;
- нітриди;
- бориди;
- карбіди.
Можлива взаємодія кремнію з азотноюкислотою або лугом, що має назву процесу травлення. Широко поширені кремнийорганические з'єднання, які сьогодні набувають все більшого поширення.
Знаходження в природі
Кремній в природі міститься в досить вагомийкількості. Варто на другому місці після кисню за поширеністю. Його масова частка становить близько 30%. Морська вода також містить даний елемент в приблизною концентрації 3 мг / л. Тому не можна сказати, що кремній в природі - це рідкісний елемент.
Навпаки, існує маса різних порід і мінералів, в складі яких він зустрічається і з яких його можна добувати. Найпоширеніші природні сполуки кремнію наступні:
- Кремнезем. Хімічна формула SiO2. Існує досить велика різноманітність форм мінералів і гірських порід на його основі: пісок, кремінь, польові шпати, кварц, гірський кришталь, аметист, халцедон, сердолік, опал, яшма та інші.
- Силікати і алюмосилікати. Каолін, шпати, слюда, солі кремнієвої кислоти, азбест, тальк.
Таким чином, поширення в природі кремнію широко, а його сполуки користуються популярністю і попитом у людей для застосування в технічних цілях.

Кремній та його сполуки
Так як в чистому вигляді розглянутий елементіснувати не може, тому важливе значення мають різні його сполуки. З хімічної точки зору він може проявляти три ступені окислення: +2, +4, -4. Виходячи з цього, а також з свою інертність, але особливою за будовою кристалічної решітки, він формує наступні основні види речовин:
- бінарні сполуки з неметалами (силан, карбід, нітрид, фосфід і так далі;
- оксиди;
- кремнієву кислоту;
- силікати металів.
Розглянемо докладніше, яке значення має кремній та його сполуки, які є найпоширенішими і затребуваними для людей.

оксиди кремнію
Існує два різновиди даної речовини, що виражаються формулами:
- SiO;
- SiO2.
Однак найбільше поширення має діоксид. Він існує в природі у вигляді дуже красивих напівкоштовних каменів:
- агат;
- халцедон;
- опал;
- сердолік;
- яшма;
- аметист;
- Горний кришталь.
Застосування кремнію в такій формі знайшло своєзастосування у виробництві ювелірних виробів. Неймовірно красиві золоті і срібні прикраси виготовляються з цими напівкоштовними каменями.
Ще кілька варіацій діоксиду кремнію:
- кварц;
- річковий і кварцовий пісок;
- кремінь;
- польові шпати.
Застосування кремнію в таких видах реалізується вбудівельних роботах, техніці, радіоелектроніці, хімічній галузі, металургії. Всі разом перераховані оксиди відносяться до єдиного речовини - кремнезему.
Карбід кремнію і його застосування
Кремній та його сполуки - це матеріали майбутньогоі сьогодення. Одним з таких матеріалів є карборунд або карбід даного елемента. Хімічна формула SiC. Зустрічається в природі у вигляді мінералу муассаніта.
У чистому вигляді з'єднання вуглецю і кремнію - це красиві прозорі кристали, що нагадують алмазні структури. Однак в технічних цілях використовуються пофарбовані в зелений і чорний кольори речовини.
Основні характеристики даної речовини, що дозволяють використовувати його в металургії, техніці, хімічній промисловості, такі:
- напівпровідник ширококутного;
- дуже високий ступінь міцності (7 за шкалою Мооса);
- стійкий до дії високих температур;
- відмінна електроустойчівость і теплопровідність.
Все це дозволяє використовувати карборунд вЯк абразивний матеріал в металургії і хімічних синтезах. А також на його основі виготовляти світлодіоди широкого спектра дії, деталі для стекловарочних печей, сопла, факели, ювелірні прикраси (муассаніт цінується вище фіаніту).

Сілан і його значення
Водневе з'єднання кремнію має назвусилан і не може бути отримано прямим синтезом з вихідних речовин. Для його отримання використовують силіциди різних металів, які піддаються обробці кислотами. В результаті виділяється газоподібний силан і формується сіль металу.
Цікаво те, що розглядається з'єднанняніколи не утворюється на самоті. Завжди в результаті реакції виходить суміш моно-, ди-і трісілана, в яких атоми кремнію з'єднані між собою в ланцюжки.
За своїми властивостями ці сполуки - сильні відновники. Самі при цьому легко окислюються киснем, іноді з вибухом. З галогенами реакції бурхливі завжди, з великим викидом енергії.
Області застосування силанов наступні:
- Реакції органічних синтезів, в результаті яких утворюються важливі кремнийорганические з'єднання - силікони, гуми, герметики, мастила, емульсії та інші.
- Мікроелектроніка (рідкокристалічні монітори, інтегральні технічні схеми та інше).
- Отримання надчистого полікремнію.
- Стоматологія при протезуванні.
Таким чином, значення силанов в сучасному світі високо.

Кремнієва кислота і силікати
Гідроксид елемента, що розглядається - це різні кремнієві кислоти. виділяють:
- мета;
- орто;
- полікремнієві і інші кислоти.
Всі їх об'єднують загальні властивості - крайнянестійкість у вільному стані. Вони легко розкладаються під дією температури. При звичайних умовах існують недовго, перетворюючись спочатку в золь, а потім в гель. Після висихання такі структури називають силикагелями. Вони використовуються в якості адсорбентів в фільтрах.
Важливими, з точки зору промисловості, є солі кремнієвих кислот - силікати. Вони лежать в основі отримання таких речовин, як:
- Скло;
- бетон;
- цемент;
- цеоліт;
- каолін;
- фарфор;
- фаянс;
- кришталь;
- кераміка.
Силікати лужних металів - розчинні, всіх інших - немає. Тому силікат натрію і калію називають рідким склом. Звичайний канцелярський клей - це і є натрієва сіль кремнієвої кислоти.
Але найцікавішими сполуками є всеж скла. Яких тільки варіантів цієї речовини не придумали! Сьогодні отримують кольорові, оптичні, матові варіанти. Скляний посуд вражає своєю пишністю і різноманітністю. При додаванні певних оксидів металів і неметалів в суміш можна отримувати найрізноманітніші типи скла. Іноді навіть однаковий склад, але різне процентний вміст компонентів призводить до різниці у властивостях речовини. Прикладом можуть служити фарфор і фаянс, формула яких SiO2* AL2O3* K2O.
Кварцові скло - це форма особливо чистого продукту, склад якого описується як діоксид кремнію.

Відкриття в області з'єднань кремнію
За останні кілька років досліджень булодоведено, що кремній та його сполуки - найважливіші учасники нормального стану живих організмів. З нестачею або надлишком даного елемента пов'язані такі захворювання, як:
- рак;
- туберкульоз;
- артрити;
- катаракта;
- проказа;
- дизентерія;
- ревматизм;
- гепатит та інші.
Самі процеси старіння організму також пов'язані зкількісним вмістом кремнію. Численні досліди на ссавців тварин довели, що при нестачі елемента виникають інфаркти, інсульти, рак і активізується вірус гепатиту.
</ P>


